ひと口に“電池”といっても、正極(プラス)や負極(マイナス)の電極材料をどう組み合わせるかの違いだけで、約40種類の構造があります。そして電池の形や大小の違いも区別して数えると、世界中では4000種類以上の電池があるといわれています。そして、これらの電池の性能が、種々の発電機からの送電・蓄電、ハイブリッドカー(HV)、電気自動車(EV)、ごく身近なものでは、スマートフォンなどの性能・効率に大きな影響を与えているのです。また、将来のスマートグリッド(次世代送電網)拡大のための重要な要素技術ともなっています。
今回のシリーズでは、磁石とは直接関係ありませんが、磁石の応用においても重要なパートナーである“電池”に焦点を当ててみました。身近ではありますが、なんとなく複雑で難しいという先入観があるため、普段あまり深く考えることが少ない“電池”について、なるべくわかり易く解説しながら、同時にご一緒に勉強をしてゆきたいと思っています。
1.電池の始まり
1660年頃、ドイツの物理学者ゲーリックは、イオウのボールの回転による摩擦で静電気を発生させる“摩擦起電機”を発明しました。その後1700 年代に入り、米国の独立宣言起草者の一人でもあるベンジャミン・フランクリンが電気には“プラスとマイナス”があることを提唱し、1752 年の有名な凧揚げ実験で、電荷がライデン瓶と呼ばれた蓄電器に集められて、雷が摩擦電気の放電現象と同じ現象であることを証明しました。
ゲーリックの摩擦起電機により静電気の研究は進展してゆきましたが、実用化を熱心に考えていたのは当時の医者でした。そんな中で1780年、イタリアの解剖医のガルバーニが、死んだカエルの足が金属のメスに触れるとけいれんを起こしたり、鉄柵に吊るしたカエルの足が雷の発生とともにピクピク動くことを見つけ、1791年その原因は動物電気(ガルバーニ電気)によるものだという論文を発表しました。
同じイタリアのボルタは、カエルの足のけいれんはガルバーニの動物電気ではなく、金属と金属との間に流れる電気によるものだと考え、数々の実験をしながら、1794年ボルタ電堆(でんつい)を発明しました。このことが、世界で初めての電流(動電気)の発見・確認となり、後の電気・電磁気学の発展に大きな役割を果たしたのです。その後電堆の改良を加えながら1799年頃、“ボルタ電池”を発明し、1836年ボルタ電池を改良した“ダニエル電池”が登場するまで、多くの電気・電磁気学上の重要な発見、発明を促進させました。
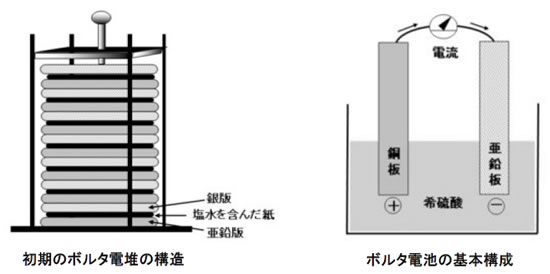
2.近代電池の分類と特徴
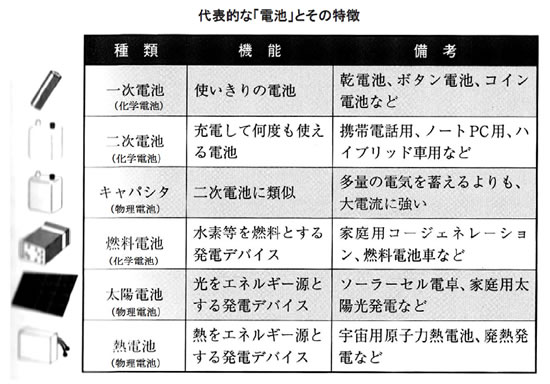
化学物質を利用して、「直流」の電気を取り出す現在のような電池の原型が発明されてから、160年余りが経ちます。そして現在、電池と呼ばれているものを“自然科学分野”で大別すると、化学反応を使って「直流の電気」を作る「化学(反応)電池」と、熱や太陽の光などを直接直流の電気に変換する物理エネルギーを利用した「物理電池」および「生物電池」の3つがあります。
(2-1)化学電池
この化学電池の仲間には、化学反応が時間とともに進んで徐々に電気を起こす力が弱くなる(使い切り)「1次電池」と、そんなときに外から電気を送り込む(充電する)と元の力を取り戻して繰り返し使用できるようになる「2次電池」、そして同じ化学反応ですが水素と酸素を使って水の電気分解とは逆の化学反応で電気を作る「燃料電池」の3つがあげられます。
このうち、1次電池と2次電池について、もう少し詳しく比較してみましょう。通常、“乾電池”と呼ばれ電気店で売られているもので、使っているうちに電圧が下がって寿命になり捨てられてしまう電池のことを“1次電池”といいます。代表的なものに「マンガン乾電池」や「アルカリ乾電池」があります。これに対して、“蓄電池”とか“充電式電池”といわれ、充電を行うことにより電気を蓄えて、再度電池として繰り返して使用できる電池を“2次電池”といいます。「鉛蓄電池」、「ニッケル水素電池」、「リチウムイオン電池」などがこの分類になります。特徴としては、1次電池も2次電池も電池として機能するためには、「正極(材料)」、「負極(材料)」、「電解液」の3つの材料がいずれも必要になります。
(2-2)物理電池
物理電池とは、光や熱などの物理的なエネルギーを電気エネルギーに変換する電池のことで、半導体の光起電力効果を利用した「太陽電池」、コンデンサの原理を応用した「電気二重層キャパシタ」、熱電素子のゼーペック効果を基にした「熱電池」などがあります。
(2-3)生物電池
酵素や菌などの生体触媒を使用し、水素やメタノール、グルコースなどと酸素とを生物電気化学的に反応させ、直接電気エネルギーを得るバイオ燃料電池のことで、広義には生物電気化学電池ということになります。代表的な電池には、「酵素電池」、「微生物電池」があります。
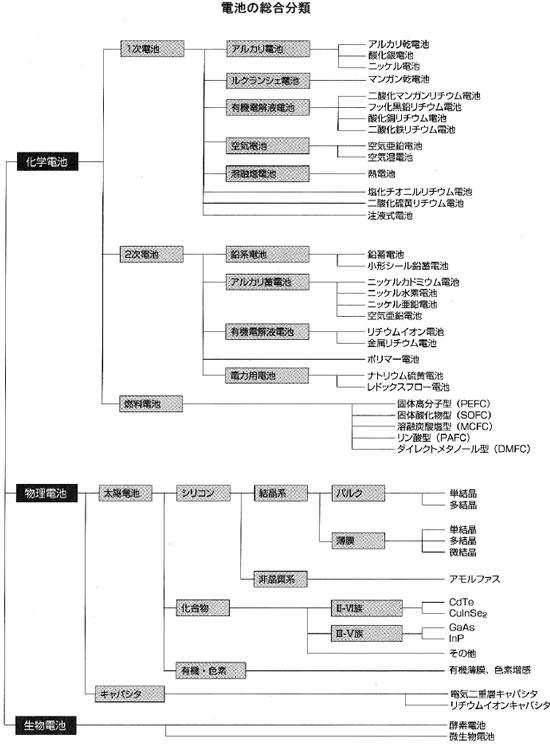
下図は以上の分類に、さらに詳細な分類と実際の電池名をまとめたものです。
3.電池の電気化学反応
学生時代に学んだ読者も多いと思いますが、ここで今一度、電池が電流を流すことができる原理をおさらいしてみましょう。少々面倒かもしれませんが、丁寧に読んで理解してください。
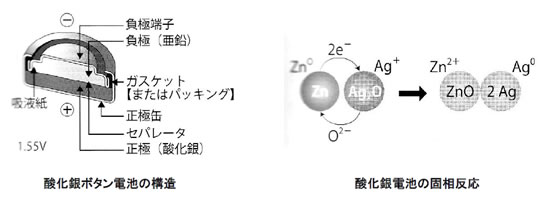
酸化銀電池(一次電池、1.55V ボタン形)を例に、通常の化学反応と電気化学反応の違いを考えてみましょう。 酸化銀電池では、電子を放出したい物質(マイナス極側)として金属亜鉛(Zn、0価)を用いるとともに、電子を受け取りたい物質(プラス極側)に酸化銀(Ag2O、Agは+1価)を用います。(左下図参照)
電気化学反応を考える前に、通常の化学反応としてZnとAg2Oの直接の反応(固相反応)を仮定してみます。Zn(金属、固体)とAg2O(固体)の界面で、
【通常の化学反応】Zn + Ag2O → ZnO + 2Ag + 熱エネルギー
が起こることが于想されます。この場合、右下図のようにまずZnから電子2個が放出され、Zn2+イオンとなります。放出された2個の電子は接触したAg2Oが受け取りAg (0価、金属)となります。同時に、Ag2Oにあった酸化物イオン(O2-)1個がZn2+と結びついてZnO(固体)を生成します。ZnとAg2Oの界面で、2個の電子と酸化物イオンとを相互に交換し、反応が進行したことになります。この状態では、ZnとAg2Oが直接接触しているので、残念ながら電子の移動を外部に取り出すことができず、エネルギーは熱の形で放出されるだけです。
では電子を外部に取り出すにはどうするのでしょうか。電気化学反応の特徴は、ZnとAg2Oを分離して(直接接触させずに)反応させることです。分離した状態で、電子は外部回路を通して、また酸化物イオンは電池内部で移動させ、相互交換を行います。
外部回路で電子の移動をさせるためには、電子を放出したいZnと電子を受け取りたいAg2Oとを分離しておき、それぞれの物質に導電性の電極(集電体)を接触させ、リード線で外部回路を形成することで電子の流れる道筋を作ることができます。ただ、電子だけを動かそうとしても、マイナス極側とプラス極側のそれぞれで電荷の過不足が生じる(電気的中性が崩れる)ので、電子は動けません。電気的中性を保つためにも、反応を完結させるためにも、酸化物イオン(O2-)の移動ルートを確保する必要があります。この役目が[電解液]です。
電解液中では、陽イオンや陰イオンが安定に存在でき、また移動することもできます。分離しておいた亜鉛(Zn)と酸化銀(Ag2O)との間に、電解液(ここでは、水にKOHを溶かした物)を介在させることで酸化銀から亜鉛への酸化物イオン(O2-)の移動(実際にはOH-として)が可能となります。以上のようにして、電子を反応系外に取り出しながら、化学反応を完結させることできるので、安定した放電が可能となるのです。(下図参照)
なお、酸化銀電池は一次電池ですので、充電すると針状の亜鉛金属(Zn)が析出し、内部短絡を起こす恐れがあるため、充電は危険です。
【電気化学反応】 ZnO + H2O + 2e- → Zn(針状金属) + 2OH-
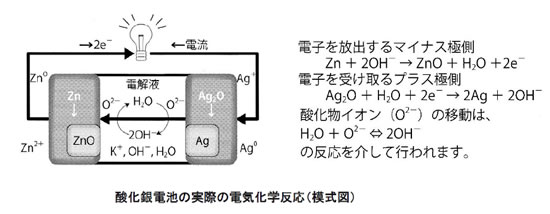
このように電池反応の特徴は、電解液で隔てられた2つの物質(電子を放出したい物質と電子を受け取りたい物質)が、外部回路を通る電子の移動と、電解液を通るイオンの移動により、直接接触しているかのような化学反応を起こすことです。
以上、今月号では電池の種別と基本的な電気化学反応について解説をしてみました。次回からは、各電池ごとにその特徴、原理、用途などを勉強してゆきたいと思っています。
<参考・引用資料>
「図解でナットク!二次電池」 小林哲彦、宮崎義憲、太田 璋 共著(日刊工業新聞社)
「トコトンやさしい2次電池の本」 細田 條 著(日刊工業新聞社)
フリー百科事典ウィキペディア「電池」、「二次電池」
電池工業会ホームページ「電池の知識」
ネオマグ(株)ホームページ「磁石の歴史」

